| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 27 | 28 | 29 | 30 |
- 오비탈 믹싱
- 캐시
- 결합길이
- flashify
- 달빅캐시
- miui
- bolbbalgan4
- 커롬
- cm12
- 플래싱
- 오비탈
- LCAO
- tekcafe
- 커스텀롬
- 시그마 결합
- cyanogenmod
- 정리장
- IMEI
- 베시업
- 루팅
- flyme
- 부트로더
- 베가
- 선형조합 오비탈
- 결합차수
- 백업
- 분자 오비탈
- TWRP
- 파이결합
- ios
- Today
- Total
정리장
#5 분자 오비탈(LCAO, MO) 본문
[서문]
안녕하세요 정리장 입니다.
다음의 글은 대학교 (일반) 과학을 다루고 있습니다. (고등학교 2과정과 비슷합니다)
이 링크의 글을 먼저 읽어보시면 이해하시기 수월할껍니다.
http://schrodingerpiano.tistory.com/notice/11
[본문]
목차
1. LCAO와 MO
2. 결합 차수, 결합 길이, 자성
1. LCAO와 MO
선형조합 오비탈과 분자 오비탈이라 부른다.

이런거다. 이해가 잘 안갈 수도 있으니 다른 그림을 첨부하겠다.
호오, 그런거구나. H원자 2개가 있다고 상상해보자. 이 두개가 결합을 하려한다. 근데 얘네는 결합하면서 따로 흡열이나 발열반응을 하지 않는다. 일단 활성화 에너지를 주면 결합을 형성하고, 근데 따로 흡열이나 발열을 하지 않기때문에 결합 한 에너지 만큼 반결합도 생성된다. 이게 원자 바깥쪽에 생성되는 전자의 반결합이다. 결합해서 에너지 준위가 낮아진 만큼 반결합으로 인한 에너지 준위는 높아진다.
뭐 이게 1s 2s 오비탈에서만 일어나면 편하다. 하지만 2p 오비탈에서 일어나는 경우 전기음성도가 앵간히 쎄지 않으면 오비탈 믹싱이라는 현상이 일어난다. 다음은 전기음성도가 쎈 O와 F의 경우이다.
O의 분자오비탈 다이어그램이다.
이게 굉장히 자연스러운 경우인데, 시그마 위에 파이 파이 위에 파이 스타(반결합) 파이 스타 위에 시그마 스타가 위치하고 있다. 그리는 법은 원자의 2p오비탈에 있는 전자수를 센다음 각각의 원자의 전자수를 더해서 에너지 준위에 따라 쌓아 올리는 것이다.
F도 같은 방식으로 쌓아올리면 된다.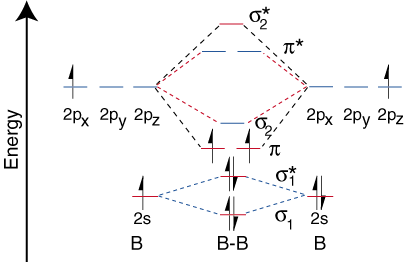
이건 B(붕소)의 다이어그램인데, 이는 O와 F를 제외한 거의 모든 분자들에게 적용된다.
이런건 2원자분자의 경우고, CO2나 다른 원소들은 각각의 오비탈들이 다른 에너지 준위를 가지기 때문에 이렇게 된다.
희한하게도 얘는 오비탈 믹싱이 일어나지 않는데 다른 분자들은 오비탈 믹싱이 일어난다.
2. 결합 차수, 결합 길이, 자성
이러한 것들은 다 다이어그램에서 판단할 수 있지만, 몇가지 규칙을 적어보자면
$$결합차수=\frac{결합 오비탈 전자수-반결합 오비탈 전자수}{2}$$
결합 길이는 결합 차수가 클수록 결합 길이는 짧아진다.
자성은 강자성, 상자성, 반자성으로 나눌 수 있는데, 강자성=영구자석, 상자성=전자석, 반자성=전자석이나 반대의 극을 가짐 으로 해석하면 편하다. 다음의 개수는 홀전자수를 의미한다.
$$강자성>2 \\ 상자성=1 \quad or \quad 2 \\ 반자성=0 $$
O2는 홀전자수가 2개이므로 상자성이라 할 수 있다.
끝
'Science > Chemistry' 카테고리의 다른 글
| #4 혼성오비탈 (1) | 2018.01.28 |
|---|---|
| #3 원자가 전자쌍 반발이론 (0) | 2018.01.28 |
| #2 시그마 결합, 파이결합 (0) | 2018.01.28 |
| #1 옥텟규칙 / 루이스 전자점식과 공명구조 (0) | 2018.01.26 |